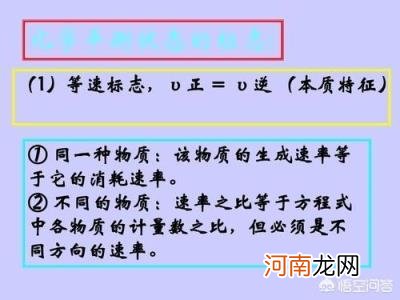
1化学平衡状态、V正=V逆
文章插图
(1)、用同一种物质来表示反应速率时:该物质的生成速率与消耗速率相等;
(2)用不同种物质来表示反应速率时:若同为反应物或产物,应方向相反,即一种生成,另一种分解,且速率之比=化学方程式中相应的化学计量数之比 。若一为反应物,另一为产物,则要均为分解或生成,同样速率之比=化学方程式中相应的化学计量数之比 。
2、物质的量、质量、物质的量浓度、成分的百分含量(体积分数、质量分数)、成分的转化率恒定均可作为达平衡的标志 。
3、总压强恒定必须针对恒容、恒温条件下气体体积有改变的反应,如N2+3H2 ≒2NH3 ,因为气体物质的量越大则压强p就越大,则无论各成份是否均为气体,只需考虑气体物质的量是否发生改变,只要气体物质的量有改变,当总压强恒定时可逆反应达平衡 。但对气体体积反应前后不变的可逆反应,由于平衡与否气体的物质的量不变,因此在恒容、恒温下P不会变 。故总压恒定不能作为确定达平衡的标志 。如:H2+I2≒2HI 。
4、混合气体的密度恒定①当反应前后各成分均为气体时恒容:ρ总为恒值,不能做平衡标志;恒压:等物质的量反应,ρ总为恒值,不能作平衡标志,如:H2+I2≒2HI 。非等物质的量反应,ρ为一定值时,可做为平衡标志,如N2+3H2 ≒2NH3 。②当有非气体物质参与时恒容:ρ为一定值时,可作平衡标志,如C+CO2≒2CO;恒压:ρ为一定值时,可作平衡标志,如:C(S)+H2O(g)≒CO(g)+H2(g) 。
5、混合气体的平均相对分子质量(M)恒定①若各物质均为气体对于非等物质的量反应,如2SO2+O2≒2SO3,M一定可做为平衡标志 。对于等物质的量反应,如H2+ Br2≒2HBr,M一定不能做为平衡标志 。②若有非气体参与,无论等物质的量还是非等物质的量反应,如C(s)+O2(g) ≒CO2(g),CO2(g)+C(s)≒2CO(g),M一定可标志达到平衡 。
6、混合气体的颜色一定对于有有色气体参与的可逆反应,当混合气体的颜色不变时,可以作为达平衡的标志 。如H2+I2 ≒ 2HI和2NO2+O2≒N2O47、当温度不随时间变化而变化 。对于隔热体系,当体系内温度一定时,则标志达到平衡 。
【化学平衡状态 化学反应达到平衡状态的标志?】有很多种 。看情况来定的,帮你找了资料,你看看吧 。。化学平衡状态的标志可概括为“一等五不变”,现以mA(g)+nB(g)pC(g)+qD(g)为例,化抽象为具体,提高学生对此标志的理解 。1.一等“一等”即正反应速率等于逆反应速率,其意义是针对反应体系中同一反应物(或生成物)而言的,而不是同一反应中的不同物质 。
若用同一反应中不同物质来表示正反应速率和逆反应速率,必须要求两速率反向(切忌单向速率)且两速率之比等于其对应的化学计量数之比 。在试题中可有以下几种具体形式出现:⑴同一物质的正反应速率等于逆反应速率,如υA(消耗)=υA(生成)或υD(消耗)=υD(生成) 。
⑵某反应物的正反应速率与另一反应物的逆反应速率之比等于化学计量数之比,如υA(消耗):υB(生成)=m:n,或υC(消耗):υD(生成)=p:q 。⑶某反应物的正反应速率与某生成物的逆反应速率之比等于化学计量数之比,如υA(消耗):υC(消耗)=m:p,或υB(生成):υD(生成)=n:q 。
⑷对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等 。2.五不变“五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变;对于全为气体的可逆反应,当m+n╪p+q时,混合气体总物质的量不变 。
- 黄鳝的寿命
- 【重要天象】十二星座2022年4月11日运势:水星移位,状态有提升
- NTZ-48 ntz-48超频状态什么意思
- 已致16人死亡,人数还将翻倍?!美国一地进入紧急状态!拜登宣布→
- 什么是干事创业的精神状态,坚决反对守成 什么是干事创业的精神
- 微醺是什么状态
- 【重要天象】十二星座2022年5月25日运势:火星移位,状态提升
- 【好运来】十二星座2022年5月28日运势:金星移位,状态提升!
- 银行反馈此卡状态异常是为什么 支付宝显示银行反馈此卡状态异常
- 如何使手机系统维持最佳状态及维护 手机系统维护怎么办?